2018年FDA新药优先审批快速发展
发布时间:2019-04-04 , 发布人:华恒智信分析员
FDA作为美国权威性较强的食品药品监督管理局,在美国销售的每一种药,在批准上市前都要接受FDA的审批。随着各国产品国际化战略的实施,越来越多的产品在进驻美国市场时需要FDA的权威认证。因此,每年FDA会对当年批注进入市场流通的新药进行统计,从近年来的统计情况看,经过FDA获批的新药数量不断增加,优先审批快速发展。
FDA新药获批数量显著增加
从获得审批的具体新药请情况看,2000年以来,新药获批总体呈上升趋势,2014年后生物制品新药获批数量大幅增加。2018年FDA新药评审中心(CDER)共批准了59个新药,其中新分子实体42个,生物制品17个,该数据打破了1996年批准53个新药的纪录。据FDA官网提供的最新公布结果,FDA在2018年全年已经陆续批准了59款新药,包括42个新分子实体和17个新生物制品,新药数量已创历史新高。

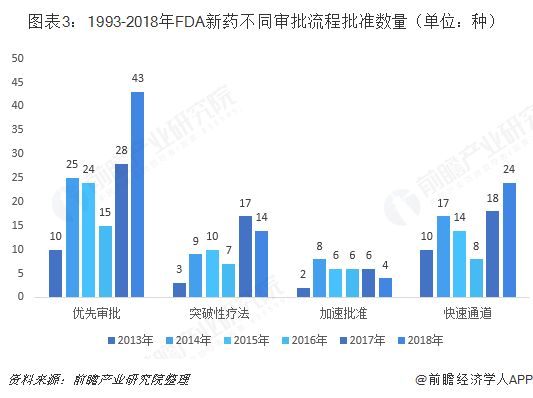
审批时间缩短,优先审批快速发展
在美国销售的每一种药物,在批准上市销售前,都必须经过FDA慎密的审查过程。为提高药品审评时间,1992年FDA创建了标准审评(Standard Review) 和优先审评(Priority Review),其中,标准审评周期为10个月,而优先审评的周期仅为6个月。
突破性疗法(breakthrough Therapy)是FDA于2012年7月创建,源于《美国食品和药物管理局安全及创新法案》(FDASIA)中第902条提出一项新指定内容,旨在加速开发及审查治疗严重的或威胁生命的疾病的新药。2013年首次使用该审评方式加快药物审批。
快速通道审评的设立主要是为了促进治疗重大疾病药物或未满足临床需求药物开发,通过加快药物审评的过程而使这些药物能更早一点到达患者手中。

从各个审批形式新药审批数量看,优先审批为主要的审批流程。2018年FDA加快对新药的审批进程,优先审批新药数量43种,快速通道新药数量24种,两种审批方法均较上年有明显的提升。突破性疗法的药物审批和加速审批新药数量较上年有所下降。
抗肿瘤免疫领域药物审批关注度提升
从FDA获批药物的治疗领域看,涵盖多个疾病领域(肿瘤、艾滋病、抗感染、偏头痛、罕见病等),以针对不同疾病的临床需求。在获批新药中,有34个孤儿药,总数超过获批品种数量的一半,可见美国在孤儿药研发领域的重要性。其中在肿瘤免疫领域,共计批准了23款新药,其中抗肿瘤审批获批新药数量为16种,较2017年增加4种。除此之外,全身用抗感染药、神经系统药物和消化系统及代谢药物的获批数量占比均在10%以上。

从美国FDA药物审批情况看,总体获得审批的新药数量不断增加,优先审批成为新药审批的重要审批方式。从获批新药的治疗领域看,抗肿瘤和免疫调节获批数量增加,表明抗肿瘤和免疫调节药物是现在研发最热的点。
作者:穆晓菲
来源:前瞻产业研究院
 扫一扫,关注
扫一扫,关注

